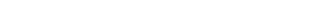El síndrome de X frágil (SXF) es la forma hereditaria más común de discapacidad intelectual, y se caracteriza por una expansión de repeticiones CGG (>200) en la región 5′-UTR del gen del retraso mental 1(FMR1), ubicado en el locus FRAXA del cromosoma Xq27.3. La prevalencia del SXF en la población general es 1 de cada 4.000 hombres y 1 de cada 8.000 mujeres (Hagerman, 2009). A nivel molecular, las personas con SXF tienen un alelo con mutación completa (MC), es decir, con más de 200 repeticiones CGG e hipermetilada la región promotora. Por ello, hay ausencia de expresión del ARNm y déficit de la proteína FMRP (Pieretti, 1991). También existe la condición de portadores no afectados en algunos familiares de personas con SXF, denominada premutación (PM). La PM es una expansión de tamaño mediano (55–200 repeticiones CGG) que, a diferencia de la MC, permanece desmetilada. En estos casos, el ARNm aumenta hasta cinco veces el nivel normal, pudiendo generar otros trastornos asociados al SXF en quienes la portan, tales como el síndrome de ataxia y temblor (FXTAS), insuficiencia ovárica primaria (FXPOI) y transtornos neuropsiquiátricos (FXAND) (Tassanakijpanich, 2021), mientras que la producción de FMRP puede ser normal o estar levemente disminuida. Por ser esta una condición de herencia ligada al X dominante, las madres portadoras de una PM tienen un elevado riesgo de que su alelo PM se expanda a una mutación completa en generaciones posteriores. La población chilena presenta una frecuencia de SXF 8% en población con discapacidad intelectual, siendo una de las más altas dentro de la población hispana (Salcedo-Arellano 2020).
Presentación clínica
El SXF afecta a personas de ambos sexos con un amplio espectro de fenotipos neuroconductuales; sin embargo, los hombres se ven afectados con mayor frecuencia que las mujeres y, en general, con mayor gravedad. Clínicamente, las características cognitivas y conductuales más comunes identificadas en los individuos con SXF son discapacidad intelectual, déficit de lenguaje, fobia social, déficit de atención, conducta agresiva e hiperactividad. Las características físicas incluyen orejas grandes prominentes, cara alargada con mentón prominente, hiperlaxitud de las articulaciones, piel lisa y pies planos. A nivel de fenotipos del neurodesarrollo, el funcionamiento cognitivo puede variar desde dificultades leves de aprendizaje hasta discapacidad intelectual severa (Hagerman, 2013).
Diagnóstico
Es frecuente que las personas con SXF presenten expansiones CGG de diferentes tamaños; es decir, algunas células presentan alelos con MC y otras con alelos PM. Esta inestabilidad de las repeticiones CGG dentro del gen FMR1 se denomina mosaicismo de "tamaño", y se presenta en el 41% de los varones afectados (Nolin, 1994). Además, algunas personas presentan mosaicismo de metilación, donde los alelos con MC se encuentran completamente metilados en algunas células, mientras que otras poseen la MC no metilada (Loesch, 2012).
Para el diagnóstico de esta condición se requiere determinar con precisión el número de repeticiones, así como el estado de metilación del promotor del locus FRAXA (Hagerman, 2008). Para esto existen diversos métodos basados en la reacción en cadena de la polimerasa (PCR), que en general son técnicas rápidas que deben ser confirmadas por Southern Blot (Santa María, 2016). Actualmente el estudio por TP-PCR (triplet repeat primed PCR) puede determinar además del tamaño de la expansión, el estado de metilación del gen (Figura 1).
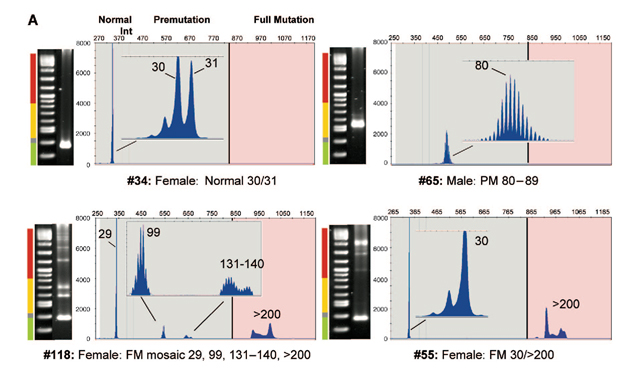
Además, dada la complejidad de la herencia del SXF, es muy importante que las familias afectadas consulten un genetista para entender el significado de un informe de laboratorio positivo y conocer el riesgo de ocurrencia de nuevos casos en sus familiares directos (Figura 2).
Tratamiento
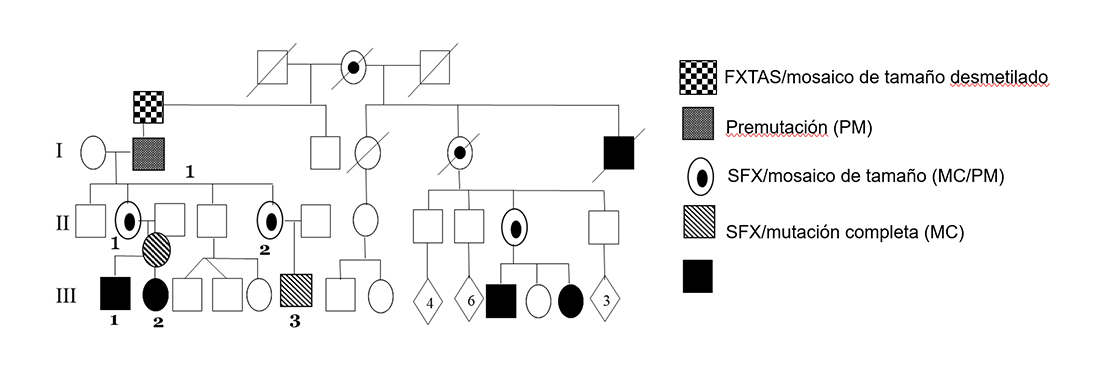
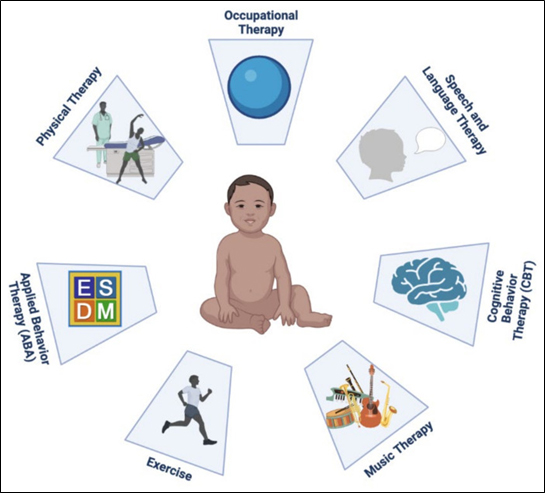
En este momento, no hay cura para esta afección. El abordaje del SXF se enfoca principalmente en el tratamiento de los comportamientos desafiantes; los medicamentos mejoran las habilidades del individuo y permiten su mejor integración en entornos educativos y sociales. Se recomienda el tratamiento psicofarmacológico en conjunto con intervención conductual, terapia del habla y del lenguaje, terapia ocupacional y apoyo educativo individualizado (Figura 3). El tratamiento de los pacientes con SXF se enfoca principalmente en controlar los síntomas neuropsiquiátricos presentes como son el trastorno de déficit atencional e hiperactividad (TDAH), la ansiedad, los trastornos de conducta y las convulsiones.
Los medicamentos antipsicóticos se usan en niños, adolescentes y adultos que muestran trastornos graves del comportamiento, como agresión o irritabilidad que interfieren con las actividades de la vida diaria. Los antipsicóticos que se usan pueden incluir aripiprazol, risperidona, quetiapina y olanzapina. Los anticonvulsivos se usan para la inestabilidad en el estado de ánimo, los medicamentos como el ácido valproico, carbamazepina y lamotrigina pueden, ocasionalmente, ser eficaces contra los comportamientos agresivos y autolesivos.
Los estimulantes del sistema nervioso central como Metilfenidato (Ritalin, Concerta) muestran una mejoría en cuadros de TDAH o del comportamiento impulsivo. Una vez que la persona con SXF alcanza la adultez, es posible que ya no necesite medicamentos estimulantes (Pugin 2014).
Conclusiones
El SXF se asocia a un amplio espectro de manifestaciones clínicas. Esta gama de presentaciones y su alta frecuencia en la población hacen que la mayoría de los médicos tengan la posibilidad de encontrarse en su práctica clínica con pacientes afectados por SXF. El estudio molecular del gen FMR1 debe ser considerado dentro del estudio de pacientes que presentan retraso del desarrollo sicomotor, discapacidad intelectual y autismo, lo que permitirá una intervención oportuna y adecuada para que así los niños con SFX alcancen su mejor potencial en todas las áreas de su desarrollo.
 |
|
FIGURA 1. Resultados del análisis por Amplidex®. Usando la metodología TP-PCR es posible determinar las distintas mutaciones en hombres y mujeres. Extraído de Published in Clinical Chemistry 2010, S. Filipovic-Sadic et al. A novel FMR1 PCR method for the routine detection of low abundance expanded alleles and full mutations in fragile X syndrome. |
 |
|
FIGURA 2. Genealogía de una familia con SXF donde el estudio molecular del diagnóstico en cascada estableció los distintos genotipos de los familiares cercanos del probando (III.3) |
 |
|
FIGURA 3. Esquema que representa intervenciones no farmacológicas en el tratamiento del SXF. Extraído de Protic D.D. et al., Fragile X Syndrome: From Molecular Aspect to Clinical Treatment. Int J Mol Sci. 2022 Feb 9;23(4):1935. doi: 10.3390/ijms23041935. PMID: 35216055; PMCID: PMC8875233. |
Referencias
- Hagerman, P. J. (2008). The fragile X prevalence paradox. Journal of Medical Genetics 45, 498–499.
- Hagerman, R. & Hagerman, P. (2013). Advances in clinical and molecular understanding of the FMR1 premutation and fragile X-associated tremor/ataxia syndrome. Lancet Neurology 12, 786–798.
- Hagerman, R, Berry-Kravis, E., Kaufmann, W. et al (2009). Advances in the treatment of fragile X syndrome. Pediatrics 123, 378–390.
- Loesch, D. Z., Sherwell, S., Kinsella, G., Tassone, F. et al (2012). Fragile X-associated tremor/ataxia phenotype in a male carrier of unmethylated full mutation in the FMR1 gene. Clinical Genetics 82, 88–92.
- Nolin, S. L., Glicksman, A., Houck, G. et al (1994). Mosaicism in fragile X affected males. American Journal of Medical Genetics 51, 509–512.
- Pieretti, M., Zhang, F. P., Fu, et al. (1991). Absence of expression of the FMR-1 gene in fragile X syndrome. Cell 66, 817–822.
- Pugin A, Faundez V, Santa María L et al. (2014) Aspectos clínicos, moleculares y farmacológicos en los trastornos asociados a gen 1 del retraso mental del X frágil. Neurología. 2014. http://dx.doi.org/10.1016/j.nrl.2014.10.009
- Salcedo-Arellano MJ, Hagerman RJ, Martínez-Cerdeño V. (2020) Fragile X syndrome: clinical presentation, pathology and treatment. Gac Med Mex.156(1):60-66
- Santa María L, Aliaga S, Faundez V et al. FMR1 gene mutations in patients with fragile X syndrome and obligate carriers: 30 years of experience in Chile. Genet. Res., Camb. (2016), vol. 98, e11
- Tassanakijpanich N, Hagerman RJ, Worachotekamjorn J. Fragile X premutation and associated health conditions: A review. Clin Genet. 2021 Jun;99(6):751-760. doi: 10.1111/cge.13924. PMID: 33443313.
La Corporación X Frágil Chile es una entidad de derecho privado si fines de lucro, que agrupa a familiares y amigos de personas afectadas por este síndrome https://www.xfragil.cl/donaaqui/